CAPACIDAD CALORÍFICA
Es la cantidad de energía necesaria para aumentar 1K la temperatura de una sustancia.
La Capacidad Calorífica © de una sustancia es una magnitud que indica la mayor o menor dificultad que presenta dicha sustancia para experimentar cambios de temperatura bajo el suministro de calor. Puede interpretarse como un efecto de Inercia Térmica.
Está dada por la ecuación:
C = Q/T [J/K]
Donde C es la capacidad calorífica, Q es el calor y T la variación de temperatura.
Se mide en joules por kelvin (unidades del SI).
La capacidad calorífica © va variando según la sustancia.
Su relación con el calor específico es:
C = c.m
En donde c es el calor específico, y m la masa de la sustancia considerada.
Igualando ambas ecuaciones, procedamos a analizar :
Q/T = c * m
De aquí es fácil inferir que aumentando la masa de una sustancia, aumentamos su capacidad calorífica, y con ello aumenta la dificultad de la sustancia para variar su temperatura. Un ejemplo de esto se puede apreciar en las ciudades costeras donde el mar actúa como un gran termostato regulando las variaciones de temperatura.
El agua es una substancia con una gran capacidad calorifica, ello queda demostrado puesto que en el experimento se puede ver como tiene gran capacidad de absorción de energia, es decir tarda mucho en calentarse y en enfriarse.
Medida de la capacidad calorífica
Para medir la capacidad calorífica bajo unas determinadas condiciones es necesario comparar el calor absorbido por una sustancia (o un sistema) con el incremento de temperatura resultante. La capacidad calorífica viene dada por:Donde:
- C es la capacidad calorífica, que en general será función de las variables de estado.
- Q es el calor absorbido por el sistema.
- ΔT la variación de temperatura
La capacidad calorífica (C) de un sistema físico depende de la cantidad de sustancia o masa de dicho sistema. Para un sistema formado por una sola sustancia homogénea se define además el calor específico o capacidad calorífica específica c a partir de la relación:
donde:
- C es la capacidad calorífica del cuerpo o sistema
- c es el calor específico o capacidad calorífica específica
- m la masa de sustancia considerada
Planteamiento formal de capacidad calorífica
Sea un sistema termodinámico en el estado A. Se define la capacidad calorífica Cc asociada a un proceso cuasiestático elemental c que parte de A y finaliza en el estado B como el límite del cociente entre la cantidad de calor Q absorbido por el sistema y el incremento de temperatura ΔT que experimenta cuando el estado final B tiende a confundirse con el inicial A.Donde
 , es una curva parametrizada mediante la temperatura, que representa el camino seguido en el espacio fásico durante el proceso c. La capacidad calorífica es, de este modo, una variable termodinámica y está perfectamente definida en cada estado de equlibrio del sistema (el signo
, es una curva parametrizada mediante la temperatura, que representa el camino seguido en el espacio fásico durante el proceso c. La capacidad calorífica es, de este modo, una variable termodinámica y está perfectamente definida en cada estado de equlibrio del sistema (el signo 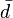 indica que no una función Q cuya diferencial sea precisamente
indica que no una función Q cuya diferencial sea precisamente 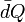 , es decir, se trata de 1-forma no exacta).
, es decir, se trata de 1-forma no exacta).Calor específico y capacidad calorífica de algunos materiales
| Material | Calor específico | Densidad | Capacidad calorífica |
| kcal/kg °C | kg/m³ | kcal/m³ °C | |
| Agua | 1 | 1000 | 1000 |
| Acero | 0,12 | 7850 | 950 |
| Tierra seca | 0,44 | 1500 | 660 |
| Granito | 0,19 | 2645 | 529 |
| Madera de roble | 0,57 | 750 | 430 |
| Ladrillo | 0,20 | 2000 | 400 |
| Madera de pino | 0,6 | 640 | 384 |
| Piedra arenisca | 0,17 | 2200 | 374 |
| Piedra caliza | 0,22 | 2847 | 484 |
| Hormigón | 0,16 | 2300 | 350 |
| Mortero de yeso | 0,2 | 1440 | 288 |
| Tejido de lana | 0,32 | 111 | 35 |
| Poliestireno expandido | 0,4 | 25 | 10 |
| Poliuretano expandido | 0,38 | 24 | 9 |
| Fibra de vidrio | 0,19 | 15 | 2,8 |
| Aire | 0,24 | 1,2 | 0,29 |
Luego se encuentra otro grupo que va de 300 a 500 kcal/m³ °C entre los que se ubica la mayoría de los materiales usuales en la construcción actual, como el ladrillo, el hormigón, las maderas, los tableros de yeso roca y las piedras areniscas.
En un último grupo se encuentra (3 a 35 kcal/m³ °C), los aislantes térmicos de masa como la lana de vidrio, las lanas minerales, el poliestireno expandido y el poliuretano expandido que por su "baja densidad" debido a que contienen mucho aire poseen una capacidad calorífica muy baja pero sirven como aislantes térmicos.
Un caso especial es el aire (0,29 kcal/m³·K; 1,214 J/m³·K), que sirve como un medio para transportar el calor en los sistemas pasivos pero no para almacenar calor en su interior.
CALOR ESPECÍFICO
El calor específico o capacidad calorífica específica, c, de una sustancia es la cantidad de calor necesaria para aumentar su temperatura en una unidad por unidad de masa, sin cambio de estado:
En donde c es el calor específico, Q es la cantidad de calor, m la masa y ΔT la diferencia entre las temperaturas inicial y final..
Su unidad en el sistema SI es el julio por kilogramo y kelvin, cuya notación es J/(kg•K). También se usa bastante las unidad del sistema técnico, la kilocaloría por kilogramo y grado Celsius y su notación es: kcal/kgºC.
También existe la capacidad calorífica molar que se relaciona con el calor específico como:
De ahí se deduce una fórmula para el calor intercambiado dependiente del número de moles (n) en vez de la masa (m).
Su unidad en SI es el joule por mol y kelvin, cuya notación es J/(mol•K)
Ecuaciones básicas
El calor específico medio ( ) correspondiente a un cierto intervalo de temperaturas
) correspondiente a un cierto intervalo de temperaturas 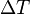 se define en la forma:
se define en la forma:donde
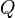 es la transferencia de energía en forma calorífica en el entre el sistema y su entorno u otro sistema,
es la transferencia de energía en forma calorífica en el entre el sistema y su entorno u otro sistema,  es la masa del sistema (se usa una n cuando se trata del calor específico molar) y
es la masa del sistema (se usa una n cuando se trata del calor específico molar) y 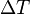 es el incremento de temperatura que experimenta el sistema. El calor específico (
es el incremento de temperatura que experimenta el sistema. El calor específico ( ) correspondiente a una temperatura dada
) correspondiente a una temperatura dada 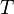 se define como:
se define como:El calor específico (
 ) es una función de la temperatura del sistema; esto es,
) es una función de la temperatura del sistema; esto es,  . Esta función es creciente para la mayoría de las sustancias (excepto para los gases monoatómicos y diatómicos). Esto se debe a efectos cuánticos que hacen que los modos de vibración estén cuantizados y sólo estén accesibles a medida que aumenta la temperatura. Conocida la función
. Esta función es creciente para la mayoría de las sustancias (excepto para los gases monoatómicos y diatómicos). Esto se debe a efectos cuánticos que hacen que los modos de vibración estén cuantizados y sólo estén accesibles a medida que aumenta la temperatura. Conocida la función  , la cantidad de calor asociada con un cambio de temperatura del sistema desde la temperatura inicial Ti a la final Tf se calcula mediante la integral siguiente:
, la cantidad de calor asociada con un cambio de temperatura del sistema desde la temperatura inicial Ti a la final Tf se calcula mediante la integral siguiente:En un intervalo donde la capacidad calorífica sea aproximadamente constante la fórmula anterior puede escribirse simplemente como:
Cantidad de sustancia
Cuando se mide el calor específico en ciencia e ingeniería, la cantidad de sustancia es a menudo de masa, ya sea en gramos o en kilogramos, ambos del SI. Especialmente en química, sin embargo, conviene que la unidad de la cantidad de sustancia sea el mol al medir el calor específico, el cual es un cierto número de moléculas o átomos de la sustancia.6 Cuando la unidad de la cantidad de sustancia es el mol, el término calor específico molar se puede usar para referirse de manera explícita a la medida; o bien usar el término calor específico másico, para indicar que se usa una unidad de masa.Conceptos relacionados
Hay dos condiciones notablemente distintas bajo las que se mide el calor específico y éstas se denotan con sufijos en la letra c. El calor específico de los gases normalmente se mide bajo condiciones de presión constante (Símbolo: cp). Las mediciones a presión constante producen valores mayores que aquellas que se realizan a volumen constante (cv), debido a que en el primer caso se realiza un trabajo de expansión.El cociente entre los calores específicos a presión constante y a volumen constante para una misma sustancia o sistema termodinámico se denomina coeficiente adiabático y se designa mediante la letra griega
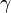 (gamma).7 Este parámetro aparece en fórmulas físicas, como por ejemplo la de la velocidad del sonido en un gas ideal.
(gamma).7 Este parámetro aparece en fórmulas físicas, como por ejemplo la de la velocidad del sonido en un gas ideal.El calor específico de las sustancias distintas de los gases monoatómicos no está dado por constantes fijas y puede variar un poco dependiendo de la temperatura.nota 2 Por lo tanto, debe especificarse con precisión la temperatura a la cual se hace la medición. Así, por ejemplo, el calor específico del agua exhibe un valor mínimo de 0,99795 cal/(g·K) para la temperatura de 34,5 °C, en tanto que vale 1,00738 cal/(g·K) a 0 °C. Por consiguiente, el calor específico del agua varía menos del 1% respecto de su valor de 1 cal/(g·K) a 15 °C, por lo que a menudo se le considera como constante.
La presión a la que se mide el calor específico es especialmente importante para gases y líquidos.
Unidades
Unidades de calor
La unidad de medida del calor en el Sistema Internacional es el joule (J). La caloría (cal) también se usa frecuentemente en las aplicaciones científicas y tecnológicas. La caloría se define como la cantidad de calor necesario para aumentar en 1 °C la temperatura de un gramo de agua destilada, en el intervalo de 14,5 °C a 15,5 °C.8 Es decir, tiene una definición basada en el calor específico.Unidades de calor específico
En el Sistema Internacional de Unidades, el calor específico se expresa en julios por kilogramo y por kelvin (J·kg-1·K-1); otra unidad, no perteneciente al SI, es la caloría por gramo y por kelvin (cal·g-1·K-1). Así, el calor específico del agua es aproximadamente 1 cal/(g·K) en un amplio intervalo de temperaturas, a la presión atmosférica; y exactamente 1 cal·g-1·K-1 en el intervalo de 14,5 °C a 15,5 °C (por la definición de la unidad caloría).En los Estados Unidos, y en otros pocos países donde se sigue utilizando el Sistema Anglosajón de Unidades, en aplicaciones no científicas, el calor específico se suele medir en BTU (unidad de calor) por libra (unidad de masa) y grado Fahrenheit (unidad de temperatura).
La BTU se define como la cantidad de calor que se requiere para elevar un grado Fahrenheit la temperatura de una libra de agua en condiciones atmosféricas normales.






