INTRODUCCION:
El calor es energía, el calor se define como la suma total de energías cinéticas de todas las moléculas constitutivas de un cuerpo pero también se define como transferencia de energía entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a diferentes temperaturas.
Los gases ideales, primero que nada definiremos que es un gas, un gas es "es una sustancia cuyo volumen es igual al volumen del recipiente que lo contiene" Un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y sus choques son perfectamente elásticos entre ellos (conservación de momento y energía cinética).
Ley de charles: es una ley de los gases ideales que va relacionando con el volumen y temperatura de una cantidad de gas ideal que mantiene una presión constante mediante cierta proporcionalidad constante directa, la ley dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura el volumen del gas disminuye.
Ley de Avogadro: es una ley de los gases ideales y dice asi "Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas"
La electricidad es simplemente un fenómeno físico cuyo origen son las cargas eléctricas y cuya energía se manifiesta en fenómenos mecánicos, térmicos, luminosos y químicos, entre otros.
La ley de coulomb, se define como, La magnitud de cada una de las fuerzas eléctricas con que interactúan dos cargas puntuales en reposo es directamente proporcional al producto de la magnitud de ambas cargas e inversamente proporcional al cuadrado de la distancia que las separa. La ley de Coulomb es válida solamente en condiciones estacionarias, es decir, cuando no hay movimiento de las cargas o, como aproximación cuando el movimiento se realiza a velocidades bajas y en trayectorias rectilíneas uniformes.
Campo eléctrico ( E ). El campo eléctrico es fuerza de acción a distancia, este fenómeno es difícil de explicar a simple vista, la fuerza gravitacional se ejerce de una masa a otra cercana.
TEMPERATURA
La temperatura es una magnitud física que expresa el nivel del calor y sea de un cuerpo de un objeto del ambiente
No siempre son proporcionales la cantidad de calor entregado a un cuerpo y la temperatura de este. Es cierto que, a medida que vamos calentando el agua de un recipiente (a medida que le vamos entregando calor), su temperatura aumenta. Sin embargo, al llegar a cien grados , esta correspondencia se pierde: el calor es invertido en transformar el agua liquida en vapor, no en aumentar su temperatura.
El calor se puede transmitir por tres medios: en los sólidos, por conducción; en los líquidos y gases, por convección; y del sol por ejemplo, nos llega por radiación. Para evitar que en ciertos utensilios domésticos el calor se propague por conducción hasta la mano, se usa un aislante; en este caso, el aislante es la baquelita, material que conduce mal el calor que se propaga por conducción.
El calor se propaga por convección en el aire; se crean así unas corrientes térmicas ascendentes que pueden ser aprovechadas por los buitres para planear sin consumir energía. Finalmente, el calor que llega del sol por radiación puede aprovecharse por medio de células solares para obtener la energía que mueve los ingenios espaciales.
Gases ideales
Un gas ideal es un gas teórico compuesto de un conjunto de partículas puntuales con desplazamiento aleatorio que no interactúan entre sí. El concepto de gas ideal es útil porque el mismo se comporta según la ley de los gases ideales, una ecuación de estado simplificada, y que puede ser analizada mediante la mecánica estadística.
En condiciones normales tales como condiciones normales de presión y temperatura, la mayoría de los gases reales se comportan en forma cualitativa como un gas ideal. Muchos gases tales como el aire, nitrógeno, oxígeno, hidrógeno, gases nobles, y algunos gases pesados tales como el dióxido de carbono pueden ser tratados como gases ideales dentro de una tolerancia razonable. Generalmente, el apartamiento de las condiciones de gas ideal tiende a ser menor a mayores temperaturas y a menor densidad (o sea a menor presión) ya que el trabajo realizado por las fuerzas intermoleculares es menos importante comparado con energía cinética de las partículas, y el tamaño de las moléculas es menos importante comparado con el espacio vacío entre ellas.
El modelo de gas ideal tiende a fallar a temperaturas menores o a presiones elevadas, cuando las fuerzas intermoleculares y el tamaño intermolecular es importante. También por lo general, el modelo de gas ideal no es apropiado para la mayoría de los gases pesados, tales como vapor de agua o muchos fluidos refrigerantes. A ciertas temperaturas bajas y a alta presión, los gases reales sufren una transición de fase, tales como a un líquido o a un sólido. El modelo de un gas ideal, sin embargo, no describe o permite las transiciones de fase. Estos fenómenos deben ser modelados por ecuaciones de estado más complejas.
El modelo de gas ideal ha sido investigado tanto en el ámbito de la dinámica newtoniana (como por ejemplo en "teoría cinética") y en mecánica cuántica (como en el "gas in a box"). El modelo de gas ideal también ha sido utilizado para modelar el comportamiento de electrones dentro de un metal (en el Modelo de Drude y en el modelo de electrón libre), y es uno de los modelos más importantes utilizados en la mecánica estadística.
La construcción y manejo de un globo para desfiles requiere conocimiento de las Leyes de los Gases. Antes de construir éste globo se determina su volumen. Conociendo el volumen preciso del globo, los ingenieros calculan la masa de una mezcla aire-helio necesaria para inflarlo y mantenerlo a volumen constante y a una temperatura dada. ¿Qué factores deben tomarse en cuenta para el llenado de éste globo en diferentes épocas del año?
Un gas se caracteriza, fundamentalmente por carecer de una forma definida y ocupar todo el volumen del recipiente que lo contiene, esto se debe a que sus moléculas están muy separadas una de las otras.
Los gases están constituidos por moléculas independientes como si fueran esferas elásticas en constante movimiento, chocando entre sí y contra las paredes del recipiente que los contiene. Si la temperatura de un gas aumenta, la agitación de sus moléculas se incrementa y en consecuencia se eleva la presión. Pero, si la presión permanece constante, entonces aumentará el volumen ocupado por el gas. Por otra parte, si un gas se comprime, se incrementan los choques entre sus moléculas y, por lo tanto, se eleva la cantidad de calor producida.
Todos los gases pueden pasar a tener un estado líquido si se les comprime a una temperatura inferior a su temperatura crítica, y se les llama gases licuados. Por ejemplo, en los tanques de gas butano que usan en tu casa, en los dirigibles, en los tanques de oxígeno líquido usados en los talleres para soldar, en los tanques de oxígeno usados en los hospitales, en el envasado de refrescos, en los aerosoles (desodorantes, pinturas, fijadores de cabello, etc.).
Los gases se dilatan 1/273 de su volumen inicial cada vez que su temperatura aumenta un grado centígrado o en un grado Kelvin (cuyas divisiones tienen la misma magnitud), por lo
que se considera el valor 1/273 como el coeficiente de dilatación de los gases. Dado que en el S.I. las temperaturas de estos se miden en Kelvin.
Para determinar el estado de un gas se deben considerar tres magnitudes físicas para una masa dada en un gas: presión, volumen y temperatura
cuando un gas es sometido a una transformación en la cual su temperatura se mantiene constante, se dice que ésta es una transformación isotérmica, y solo observamos variaciones en su presión y su volumen.
En 1 662, el inglés Robert Boyle, que es considerado el padre de la química moderna, llevó a cabo un estudio de los gases respecto a los cambios de su volumen, como consecuencia de las variaciones en la presión aplicada, enunciando la siguiente ley que lleva su nombre.
La definición de la Ley de Boyle significa que cuando un gas se puede dilatar o contraer, la presión dentro del gas varía en proporción inversa con el volumen; es decir, si se duplica el volumen, la presión baja a la mitad, y viceversa.
LEY DE CHARLES
EL primero en hacer mediciones acerca de los gases que se expanden al aumentar su temperatura fue el científico francés Jacques Alexandre César Charles, aproximadamente en 1787, y enunció una ley que lleva su nombre.
Para una masa dada de un gas cualquiera, el volumen que ocupa es directamente proporcional a su temperatura si la presión se mantiene constante.
Matemáticamente esta ley se enuncia como:
V/T=K
Todos los gases aumentan su volumen cuando aumenta la temperatura. Al duplicar la temperatura absoluta de un gas a presión constante se duplica su volumen.
Para dos estados diferentes en volumen y temperatura (inicial y final), tenemos:
V1/T1=K .... (1) V2/T2=K...... (2)
Como K es una constante, sustituye la ecuación (2) en la ecuación (1):
V1/T1= V2/T2
LEY DE GAY- LUSSAC
El científico francés Joseph Louis Gay – Lussac, aproximadamente en 1 802, encontró la relación existente entre la temperatura y la presión de un gas cuando el volumen del recipiente que lo contiene permanece constante, a través de la siguiente ley que lleva su nombre:
P1/T1=K
Para un estado inicial y otro final,
P1/T1=K P2/T2=K
Igualando:
P1/T1=P2/T2
LEY DE AVOGADRO
Volúmenes iguales de gases diferentes a la misma presión y temperatura, contienen el mismo número de moléculas.
El valor del número de Avogadro, fue determinado por Jean-Baptiste Perrin, y es una cantidad constante para todos los gases, muy útil en los cálculos realizados en las reacciones químicas.
ECUACION DEL ESTADO DEL GAS IDEAL
Es un gas hipotético que permite hacer consideraciones prácticas que facilitan los cálculos matemáticos. Se caracteriza por que sus moléculas están muy separadas unas de otras, razón por la cual carecen de forma y ocupan el volumen del recipiente que lo contiene y son sumamente compresibles debido a la mínima fuerza de cohesión entre sus moléculas.
on base en las leyes de BOYLE, CHARLES y GAY LUSSAC, se estudia la dependencia existente entre dos propiedades de los gases, conservándose las demás constantes, esto parte de la consideración que la relación PV/T, será siempre constante.
Y SE REPESENTA P1V1/T1=P2V2/T2
LEY GENERAL DEL ESTADO GASEOSO
El volumen ocupado por la unidad de masa de un gas, es directamente proporcional a su temperatura absoluta, e inversamente proporcional a la presión soportada
Donde (P1,V1,T1) pueden considerarse como las condiciones del estado inicial y (P1.V1 Y T1) las condiciones del estado final. Por lo tanto la Ley General de Estado Gaseoso establece que para una masa dada de un gas, su relación PV/T siempre será constante.
ELECTRICIDAD
Fenómeno que tiene lugar como consecuencia de ciertas interacciones repulsivaso atractivas que aparecen entre los cuerpos de carga eléctrica.
La importancia que revisten los fenómenos de la electricidad actualmente reside en el aprovechamiento de las características que presenta la energía. Si dos cuerpos se atraen eléctricamente, y los queremos mantener separados, tendremos que hacer una fuerza para evitar que se dirijan el uno hacia el otro, es decir tendremos que realizar un trabajo para mantenerlos separados. Por lo tanto, las fuerzas eléctricas crean una energía, ya que son capaces de hacer adquirir una cierta velocidad a los objetos, y obligan a realizar trabajo para anularlas.la corriente eléctrica no es otra cosa que flujo de partículas cargadas eléctricamente que se trasladan a lo largo de conductores, porque son atraídas hacia un extremo de estos. A su paso, estas partículas son capaces de entregarnos parte de la energía que las fuerzas eléctricas producen. Las aplicaciones de los fenómenos eléctricos en la moderna sociedad industrial son innumerables.
Electrón; partícula elemental que forma la corteza de los átomos. El electrón es un partícula ligera (su masa es de 9,1x10-31kg) y totalmente estable (aun cuando se halla fuera del átomo, no se desintegra).
Protón; partícula elemental de carga positiva, pesada y establece que junto con el neutrón, forma el núcleo de los átomos
LEY DE COLOUMB
Las primeras mediciones cuantitativas de la fuerza entre dos cuerpos cargados (cargas puntuales), fueron realizadas por el científico e ingeniero francés Charles Coulomb, en 1780, este probó la ley que lleva su nombre.
Charles de Coulomb (1736-1806), físico francés, pionero en la teoría eléctrica. Nació en Angulema y trabajó como ingeniero militar al servicio de Francia en las Indias Occidentales (actuales Antillas), pero se retiró a Blois (Francia) durante la Revolución Francesa para continuar con sus investigaciones en magnetismo, rozamiento y electricidad. En 1777 inventó la balanza de torsión para medir la fuerza de atracción magnética y eléctrica. Con este invento, Coulomb pudo establecer el principio, conocido ahora como ley de Coulomb, que rige la interacción entre las cargas eléctricas.
En 1779 publicó el tratado Teoría de las máquinas simples, un análisis del rozamiento en las máquinas. Después de la Revolución, Coulomb salió de su retiro y ayudó al nuevo gobierno en la planificación de un sistema métrico decimal de pesos y medidas. La unidad de medida de carga eléctrica, el culombio, recibió este nombre en su honor.
En el universo existen fuerzas de contacto, son aquellas producidas por cuerpos en movimiento estudiadas por las leyes del físico Isaac Newton; pero también existen fuerzas producidas por un enorme número de objetos que no están en contacto, éstas se rigen por las siguientes leyes:
Ley de Newton de la Gravitación Universal.
E=E1 + E2 + E3
F=G m1 m2/r2
Ley de Coulomb de las fuerzas electrostáticas.
F=K q1q2/r2
Ambas leyes demuestran que las fuerzas producidas por grandes masas (m) o cargas eléctricas (q) dependen de la distancia de separación entre ellas. Por lo tanto, al aplicarlas es importante considerar ciertas propiedades del espacio que las rodea.
Campo eléctrico ( E ).
Como hemos visto, tanto la fuerza eléctrica como la gravitacional son ejemplos de fuerza de acción a distancia. Los físicos interesados en el estudio de este fenómeno difícil de explicar a simple vista, han demostrado de manera experimental que la fuerza gravitacional se ejerce de una masa a otra cercana, como se puede constatar con todos los cuerpos que se encuentran dentro del campo gravitacional de la tierra y de la misma manera se puede aplicar éste concepto a todos los objetos cargados eléctricamente. El espacio que rodea a dicho objeto cargado, se altera con la presencia de un campo eléctrico en éste espacio.
Es importante recordar que el campo eléctrico es una propiedad asociada con el espacio que rodea a la carga eléctrica, es decir, que existirá siempre un campo eléctrico alrededor de un cuerpo cargado independientemente si se coloca o no una carga en el
Alumnos de 5H . Cd. Obregon Sonora Mexico a 2 de noviembre del 2011



 , es una curva parametrizada mediante la temperatura, que representa el camino seguido en el
, es una curva parametrizada mediante la temperatura, que representa el camino seguido en el 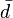 indica que no una función Q cuya diferencial sea precisamente
indica que no una función Q cuya diferencial sea precisamente 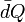 , es decir, se trata de
, es decir, se trata de  ) correspondiente a un cierto intervalo de temperaturas
) correspondiente a un cierto intervalo de temperaturas 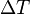 se define en la forma:
se define en la forma:
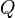 es la transferencia de energía en forma calorífica en el entre el sistema y su entorno u otro sistema,
es la transferencia de energía en forma calorífica en el entre el sistema y su entorno u otro sistema,  es la masa del sistema (se usa una n cuando se trata del calor específico
es la masa del sistema (se usa una n cuando se trata del calor específico  ) correspondiente a una temperatura dada
) correspondiente a una temperatura dada 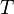 se define como:
se define como:
 . Esta función es creciente para la mayoría de las sustancias (excepto para los gases
. Esta función es creciente para la mayoría de las sustancias (excepto para los gases 

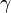 (
(